2 모델링과 시뮬레이션을 이용한 특수집단에서 약물 인허가 현황
2.1 미국 FDA의 인허가에 사용된 예
FDA에서 모델링과 시뮬레이션을 활용한 약물의 허가 사항에서 레이블에 반영되는 예는 증가 추세에 있으며 심사에서 사용되는 경우는 더 많아서 2015년 한해에만 40여개에 이른다. (그림 2.2) (Zhao 2016) 2008년에서 2015년까지 FDA의 Office of Clinical Pharmacology에서는 180건의 PBPK 모델링을 사용한 심사가 이루어졌으며 PBPK를 사용한 FDA NDA 제출 현황 및 성격 분류가 제시되었다. (그림 2.1) (Mehrotra et al. 2016)1
![PBPK를 사용한 FDA NDA 제출 현황 및 성격 분류 [@Mehrotra_2016]](assets/fda.jpg)
그림 2.1: PBPK를 사용한 FDA NDA 제출 현황 및 성격 분류 (Mehrotra et al. 2016)
![2009-2015년 동안 FDA에서 PBPK에 의한 정보가 약물 레이블에 반영된 예 [@drug-label]](assets/drug-label.jpg)
그림 2.2: 2009-2015년 동안 FDA에서 PBPK에 의한 정보가 약물 레이블에 반영된 예 (Zhao 2016)
66%는 약물상호작용에 대한 것이었고 나머지 34%는 소아 환자, 간장애, 신장애 등에 대한 내용으로 PBPK가 활용되었다.
2.1.1 소아
FDA의 소아 환자에 대한 약물 허가에서 예가 제시 되었다. (표 2.1) 여러가지 예가 제시되었지만 소아에서 에소메프라졸을 미란성 식도염을 동반한 GERD 치료시 정맥 투여 용법을 예측하는데 사용한 예를 대표적으로 들 수 있다. (Mehrotra et al. 2016) 소아용 약물의 개발에서 생리기반 약동학 모델링으로 약물을 평가하여 인허가를 결정하는 다수의 예가 보고되고 있다. (Leong et al. 2012; Mehrotra et al. 2016)
CYP450 효소와 발달 과정의 여러 생리학적 인자를 수치화 하여 PBPK 모델링으로 용량-반응 관계를 평가가능하다. (Leong et al. 2012) 네가지 약물에 대해서 각 특성을 정리하였다.
| 구분 | 약물 |
|---|---|
| 소아 | Esomeprazole |
| 소아 | Vigabatrin |
| 소아 | Adalimumab |
| 소아 | Darunavir |
| 소아 | Topiramate |
| 소아 | Pralidoxime |
| 소아 | Peramivir |
- Esomeprazole in Pediatrics for the Treatment of Gastroesophageal Reflux Disease with Erosive Esophagitis: Intravenous Dose Selection (Mehrotra et al. 2016)
- Approval of Vigabatrin for Refractory Complex Partial Seizures in Pediatrics (Mehrotra, 2016, Drug Metabolism and Disposition)
- Adalimumab: Crohn’s Disease in Children: Dose Selection (Mehrotra, 2016, Drug Metabolism and Disposition)
- Darunavir : Exposure-Response and PK Matching to Bridge Dosing for Different Patient Populations in Pediatrics for the Treatment of Human Immunodeficiency Virus (Mehrotra, 2016, Drug Metabolism and Disposition)
- Topiramate: Topiramate Dosing Regimen was Derived by Matching Steady State Trough Concentrations (CMIN) for Different Age Groups
- Pralidoxime: Derived and recommended Pediatric Dosing Recommendations without any empirical data
- Peramivir: Derived and recommended Pediatric Dosing Recommendations without any empirical data
2.1.2 임산부
임산부를 대상으로 한 임상시험은 극도로 수행하기 힘들거나 불가능하기 때문에 대부분의 약물이 경험적으로 사용되거나 근거없이 사용되고 있다. 용량 뿐만아니라 모체-태아 약동학 및 효력에 대한 종합적인 고려를 위해서는 모델링과 시뮬레이션이 반드시 사용되어야 한다. FDA에서 임산부에서의 PBPK를 활용한 약물의 인허가 관련 내용은 다음 문헌에서 발표되었다.
- Ke AB, Nallani S, Zhao P, et al. A PBPK Model to Predict Disposition of CYP3A-metabolized Drugs in Pregnant Women: Verification and Discerning the Site of CYP3A Induction. Clin Pharmcol Ther: Pharmacometrics & Systems Pharmacology, 2012 (Ke et al. 2012)
- Ke AB, Nallani SC, Zhao P, Rostami-Hodjegan A, Isoherranen N, Unadkat JD. A Physiologically Based Pharmacokinetic Model to Predict Disposition of CYP2D6 and CYP1A2 Metabolized Drugs in Pregnant Women. Drug Metab Dispos. 41:801-13. 2013 (Ke et al. 2013)
![임산부에서 미다졸람과 니페디핀의 임신 중(T3)과 출산 후(PP)의 농도-시간 곡선의 차이. [@Ke_2012]](assets/pregnancy.jpg)
그림 2.3: 임산부에서 미다졸람과 니페디핀의 임신 중(T3)과 출산 후(PP)의 농도-시간 곡선의 차이. (Ke et al. 2012)
임산부에서 CYP3A에 의해 대사되는 약물들인 미다졸람과 니페디핀의 임신 중(T3)과 출산 후(PP)의 농도-시간 곡선의 차이가 나타났으며 이에 따라 임신 중에 투여되어야 하는 약물 용량을 적절히 조정할 수 있다. (Ke et al. 2012) 또한 CYP2D6, CYP1A2에 의해 대사되는 약물들에 대한 문헌도 출판되어 있다. (Ke et al. 2013)
2.1.3 간장애, 신장애
간장애, 신장애에서의 PBPK 모델링 사용 예가 다음 문헌에서 찾을 수 있다.
- Grillo JA, Zhao P, Bullock J, et al, Utility of a physiologically–based pharmacokinetic (PBPK) modeling approach to quantitatively predict a complex drug–drug–disease interaction scenario for rivaroxaban during the drug review process: implications for clinical practice, Biopharm Drug Dispo, 2012
- Zhao P, de LT Vierira M, Grillo J, et al, Evaluation of Exposure Change of Non-renally Eliminated Drugs in Patients with Chronic Kidney Disease Using Physiologically-based Pharmacokinetic Modeling and Simulation. J Clin Pharmacol, 2012
2.2 유럽 EMEA의 인허가에서 사용된 예
2013년에 설립된 MSWG은 EMEA 내외의 다수의 계량약리학자들로 구성되어 있어 모델링과 시뮬레이션을 사용한 심사의뢰에 대해 분석 및 평가를 수행한다. 2015년 EMEA MSWG (Modeling and Simulation Working Group)에 의뢰된 관련 업무의 사례 수 (그림 2.4)가 공개되어 있으며, 의뢰된 모델링과 시뮬레이션 관련 업무에서 가장 많은 비중을 차지하는 것은 소아에서 용량 결정하는 것(53%, paediatric dose finding extrapolation) 이었다.
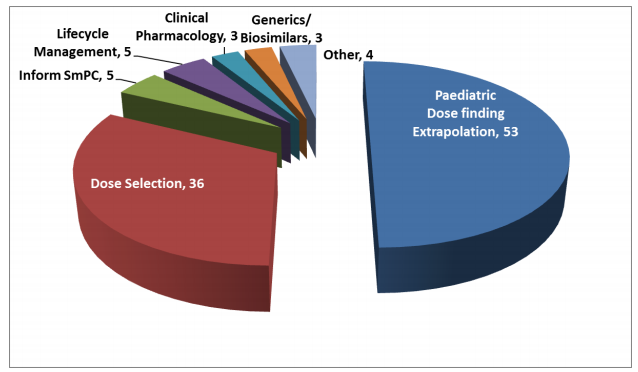
그림 2.4: 2015년 EMEA MSWG (Modeling and Simulation Working Group)에 의뢰된 관련 업무의 사례 수. Reference: http://www.ema.europa.eu/docs/en_GB/document_library/Report/2017/03/WC500222778.pdf
참고문헌
Ke, A. B., S. C. Nallani, P. Zhao, A. Rostami-Hodjegan, N. Isoherranen, and J. D. Unadkat. 2013. “A Physiologically Based Pharmacokinetic Model to Predict Disposition of CYP2D6 and CYP1A2 Metabolized Drugs in Pregnant Women.” Drug Metabolism and Disposition 41 (4): 801–13. https://doi.org/10.1124/dmd.112.050161.
Ke, A B, S C Nallani, P Zhao, A Rostami-Hodjegan, and J D Unadkat. 2012. “A PBPK Model to Predict Disposition of CYP3A-Metabolized Drugs in Pregnant Women: Verification and Discerning the Site of CYP3A Induction.” CPT: Pharmacometrics & Systems Pharmacology 1 (9): e3. https://doi.org/10.1038/psp.2012.2.
Leong, R, M L T Vieira, P Zhao, Y Mulugeta, C S Lee, S-M Huang, and G J Burckart. 2012. “Regulatory Experience with Physiologically Based Pharmacokinetic Modeling for Pediatric Drug Trials.” Clinical Pharmacology & Therapeutics 91 (5): 926–31. https://doi.org/10.1038/clpt.2012.19.
Mehrotra, N., A. Bhattaram, J. C. Earp, J. Florian, K. Krudys, J. E. Lee, J. Y. Lee, et al. 2016. “Role of Quantitative Clinical Pharmacology in Pediatric Approval and Labeling.” Drug Metabolism and Disposition 44 (7): 924–33. https://doi.org/10.1124/dmd.116.069559.
Sato, M, Y Ochiai, S Kijima, N Nagai, Y Ando, M Shikano, and Y Nomura. 2017. “Quantitative Modeling and Simulation in PMDA: A Japanese Regulatory Perspective.” CPT: Pharmacometrics & Systems Pharmacology 6 (7): 413–15. https://doi.org/10.1002/psp4.12203.
Zhao, Liang. 2016. Mechanistic Oral Absorption Modeling and Simulation for Formulation Development and Bioequivalence Evaluation; Public Workshop. U.S. Department of Health; Human Services Food; Drug Administration. https://www.fda.gov/downloads/Drugs/NewsEvents/UCM505000.pdf.
![PBPK가 사용되어 작성된 17개 약물 NDA의 분류 [@Sato_2017]](assets/japan.jpg)